重磅!“微小核糖核酸(microRNA)检测”纳入国家医疗服务收费项目!
近日,国家卫生健康委、国家中医药局、国家疾控局3部门联合印发《全国医疗服务项目技术规范(2023年版)》,“微小核糖核酸(microRNA)检测”于国家层面纳入医疗服务收费项目!
“微小核糖核酸(microRNA)”纳入医疗服务收费项目
《项目技术规范》于国家层面首次纳入微小核糖核酸(microRNA)检测服务收费项目。
解读
1. miRNA从既往的创新体外诊断标志物发展为一种可在标准场景下实施操作的体外诊断标志物
众所周知,实现微小核糖核酸(microRNA)检测的稳定性具有较高的技术壁垒。因此,从2017年miRNA7™作为最早获批的microRNA IVD试剂盒上市至今,国内获批上市的microRNA体外诊断产品仍不到5个。 但本次规范修订仍将microRNA检测列入新的《项目技术规范》,充分证明以miRNA7™为代表的microRNA检测在检测方法的准确性,以及相应临床场景中的应用价值获得国家最高监管机构的高度认可。
2. miRNA已从现有的血液样本检测拓展到各类其他样本,为miRNA的临床应用奠定了更广泛的发展基础
miRNA7™作为最早获批的肝癌分子 IVD试剂盒,其样本适用类型为外周血。随着近些年临床基础研究的推进,来自不同临床检材(如FFPE组织,粪便等)的microRNA检测,都被充分证明具有重要的临床应用价值。 因此,本次规范将microRNA检测由最早的外周血扩充为各种样本类型,为未来microRNA在多种疾病领域拓展应用奠定了基础。
3. 顿慧医疗的miRNA7™产品有效地推动miRNA行业标准化
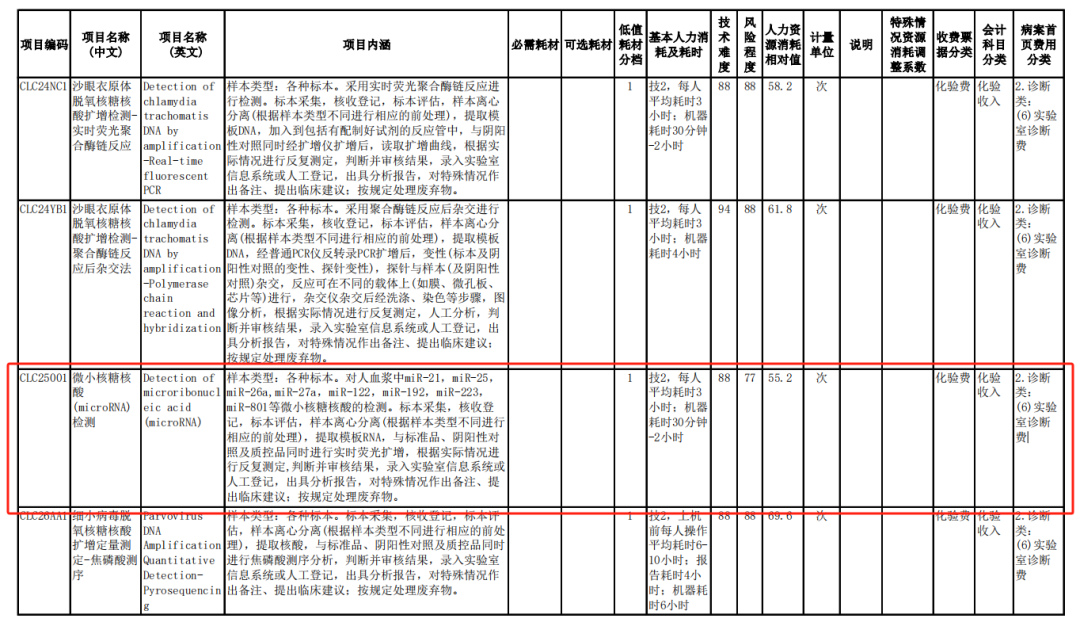
该规范中定义的微小核糖核酸 (microRNA) 检测的项目,明确指出对人血浆中miR-21,miR-26a,miR-27a,miR-122,miR-192,miR-223,miR-801等微小核糖核酸的检测。这些microRNA标志物,覆盖了顿慧医疗“7种微小核糖核酸检测试剂盒”的7种微小核糖核酸标志物。 顿慧医疗自miRNA7™上市以来,已完成了全国主要省市及核心医院的物价申报、医院准入及临床宣教。miRNA7™,作为我国首个获得国家药品监督管理局(NMPA)批准的三类肝癌分子检测产品,荣膺2020年度国家科学技术进步二等奖,并被纳入《原发性肝癌诊疗指南(2022年版)》 等多个权威指南和共识。miRNA7™检测试剂盒凭借其优良的性能,在由上海临检中心牵头的全国多中心一致性评价中收到优异的成绩,结果将在最近见刊发表。





