独乐乐?众乐乐?谈谈液体活检标志物CTC和ctDNA

CTC作为液体活检的重要研究对象,包含广泛的肿瘤信息。本专栏将介绍CTC的特性,临床应用,研究手段,最新研究进展等内容。关于CTC的前世今生,您关注的为您一一奉上。
摘要
ctDNA与CTC是目前最受关注的两类液体活检靶标,两者均已获多项指南推荐应用于临床。两者到底有什么样的差别?两者的临床应用现状如何?这些都是目前液体活检领域的重点关注问题。CTC和ctDNA二者各具优势,互为补充,分别从不同的侧面来反映肿瘤的特征,CTC具有完整的细胞形态,结果的可信度更高,涵盖更广泛的肿瘤细胞的信息。不过CTC的检测相对更难,因此如何将CTC进行高效准确地富集和鉴定,是CTC的研究重点。目前有多项前沿研究报道了CTC联合ctDNA进行临床应用,大大提高了临床检测性能。
1. CTC和ctDNA所含肿瘤信息和下游应用
CTC是游离在体液中的肿瘤组织脱落的细胞,包含一个完整的肿瘤来源细胞结构,因此细胞中所含有的信息,包括DNA水平的点突变、InDel突变、CNV、基因融合,表观水平的DNA修饰,转录水平的基因表达,蛋白水平的蛋白表达,代谢水平的代谢物积累等各个层面的遗传信息都可以检测到,全面的遗传信息使得CTC在监控肿瘤进展、用药指导和预后评估等多个领域都可以展开广泛的临床应用[1]。此外,CTC本身的形态学特征,包括细胞大小、细胞形状、特定抗原表达强度等同样具有一定的临床应用价值[2]。
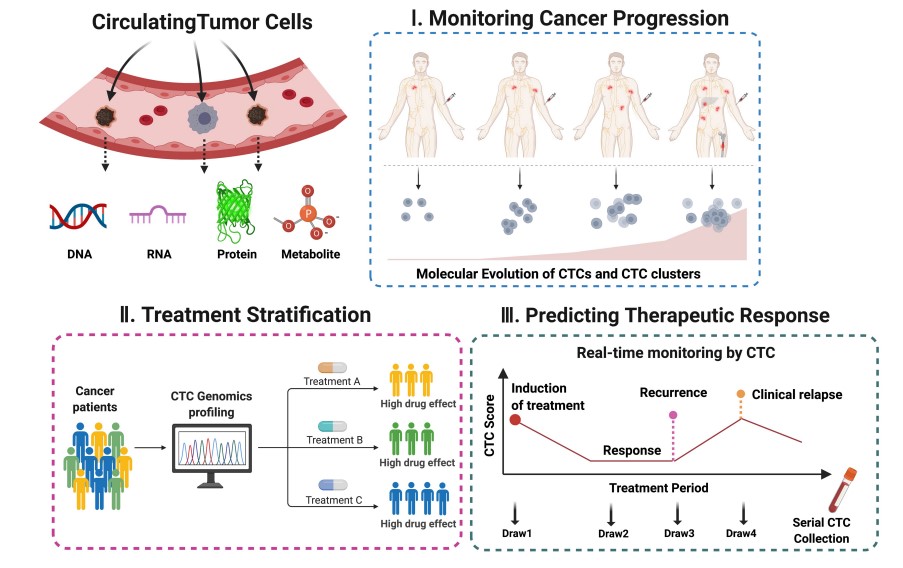
在获得CTC后,可以从多个层面开展对于CTC的研究,具体包括CTC单细胞水平多组学分析、CTC体外培养和药敏试验以及CTC与其它各类细胞的互作关系等[3]。

在单个细胞水平,可以就CTC的个数、蛋白marker表达、形态学分型、单细胞基因组、单细胞转录组、以及肿瘤细胞的异质性等多个层面可开展临床和科研的各项分析。
顿慧医疗的CTC检测支持超高维度的形态学研究,联合人工智能分析进行CTC精准分层以探索更多的临床应用潜能,并可进一步联合基因组,转录组,蛋白组和代谢组等多组学分析为揭开CTC神秘面纱提供更多数据支持。
顿慧医疗与复旦大学(附属中山医院)肝癌研究所樊嘉院士、杨欣荣教授团队合作,利用单细胞测序解析了肝癌患者不同组织部位的CTC的异质性和免疫逃逸机制,相关结果发表于Nature Communications杂志[4]。

CTC与其它各类细胞的互作是目前关于CTC研究的前沿,CTC在外周的含量很低,可以通过与各类细胞聚集形成聚合物,大大降低患者预后[5]。顿慧医疗可定制解析CTC与各类细胞形成的聚合物,与复旦大学附属中山医院检验科郭玮教授团队和肝外科孙云帆教授团队的合作研究表明,血小板粘附CTC是泛癌种中的普遍现象,通过CD155-TIGIT介导NK细胞的免疫逃逸,与HCC不良预后相关。相关研究发表于Hepatology杂志[6]。

ctDNA是游离在体液中的片段化肿瘤来源DNA,包含的是166bp左右的DNA片段,不包含RNA,蛋白和代谢物等信息,由此可以综合地检测肿瘤来源DNA水平的突变、拷贝数异常、甲基化以及DNA片段化信息,即片段组学[7,8]。

编辑自:Bach et al., 2019; Kim et al., 2022
具有代表性和引领性的TRACERx研究检测肿瘤组织和ctDNA基因谱改变,从而揭示了早期肺癌及其术后复发过程中的肿瘤种系变化框架,提示ctDNA检测复发阳性可比临床CT影像提早提示复发[9]。

值得注意的是,该研究仅分析了ctDNA的点突变情况,并未就CNV变异进行检测,而据此研究基础上开发的tumor-informed MRD检测产品,也是仅关注了ctDNA的点突变。ctDNA中的CNV变异检测及其临床应用价值,有待进一步的研究。
2. CTC与ctDNA的强强联合,提供更广泛的临床应用
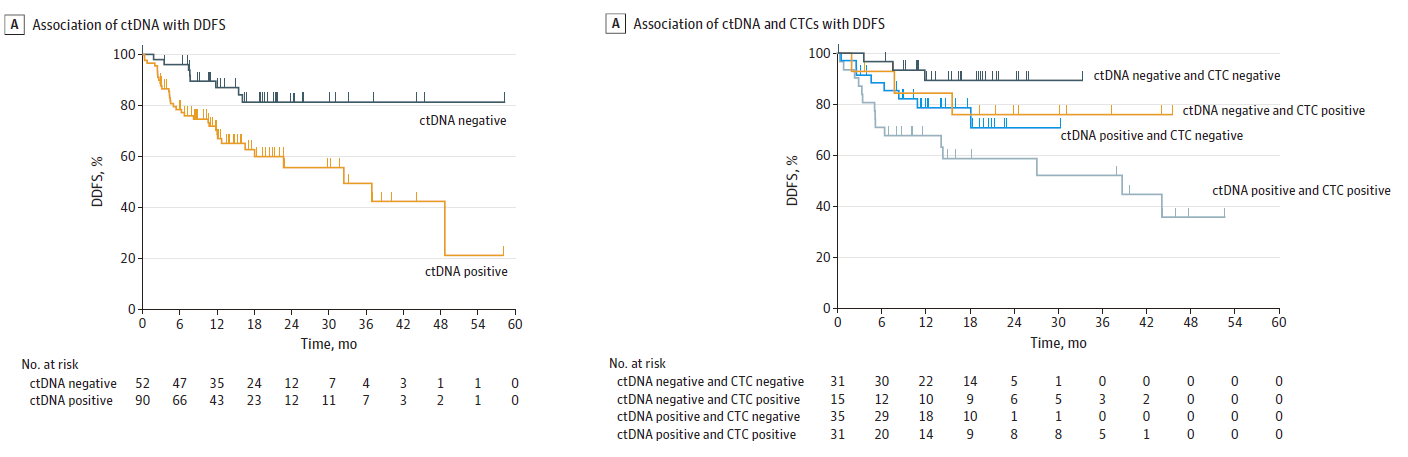
现阶段已经开展了一系列基于CTC和ctDNA联合检测的临床试验,多项研究提示了两者在临床应用中的广泛前景[9-12]。鉴于样本中含量稀少导致的取样误差,CTC和ctDNA都存在一定比例的假阴性,将两者结合不失为一个有效的策略。一项含196名TNBC患者的临床试验结果显示,ctDNA阳性患者DDFS较差(median DDFS, 32.5 months vs not reached;hazard ratio [HR], 2.99; 95%CI, 1.38-6.48; P = .006);而联合CTC和ctDNA的液体活检可提高其检测灵敏性,两者双阳患者比双阴患者的预后更差(median DDFS, 32.5 months vs not reached; HR, 5.29; 95%CI, 1.50-18.62; P = .009)[13]。
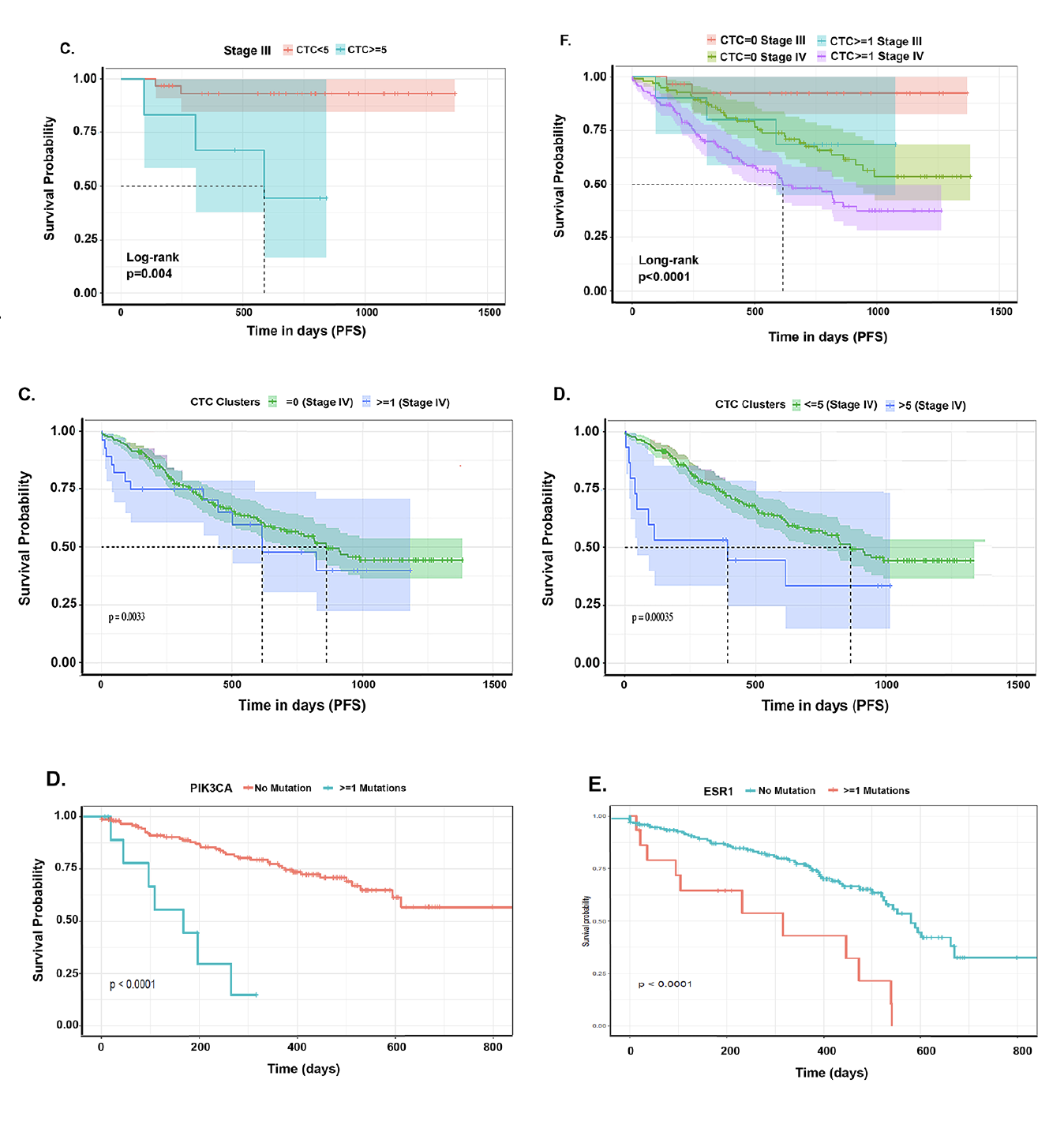
今年8月份,Clinical Cancer Research发表了一项联合CTC和ctDNA应用于局部晚期乳腺癌的预后评估的研究,该研究纳入292名患者,结果显示CTC数目和CTC细胞团数目与患者的PFS相关,ctDNA中PIK3CA和ESR1突变与乳腺癌的转移和预后相关[14]。
小结
CTC和ctDNA二者各具优势,互为补充,分别从不同的侧面来反映肿瘤的特征,CTC代表的是特异的单个肿瘤细胞,而ctDNA混合了所有肿瘤细胞的信息,综合两方面的信息可以为患者的整个病程提供更加全面的认识。ctDNA片段化严重,所含的遗传信息较少,并且区分肿瘤来源的ctDNA和正常细胞来源的游离DNA(cell-free DNA,cfDNA)是一个不小的挑战。CTC具有完整的细胞形态,结果的可信度更高,除了可以覆盖ctDNA的所有检测之外,还可以进行mRNA的相关检测,染色体层面的缺失、扩增和融合检测,以及计数、形态观察、蛋白表达和功能研究等。不过CTC的检测相对更难,因此如何将CTC进行高效准确地富集和鉴定,是CTC的研究重点。
顿慧医疗的CTC富集和鉴定技术,后续将为您做详细介绍,敬请期待。
参考文献:
1, Liu et al., Circulating Tumor Cells (CTCs): A Unique Model of Cancer Metastases and Non-invasive Biomarkers of Therapeutic Response. Front Genet, 2021 Aug 25:12:734595.
2, Wang et al., Circulating tumor cell detection and single-cell analysis using an integrated workflow based on ChimeraX-i120 Platform: A prospective study. Mol Oncol, 2021 Sep;15(9):2345-2362.
3, Yang et al., Circulating Tumor Cells from Enumeration to Analysis: Current Challenges and Future Opportunities. Cancers (Basel). 2021 May 31;13(11):2723.
4, Sun et al., Dissecting spatial heterogeneity and the immuneevasion mechanism of CTCs by single-cell RNA-seq in hepatocellular carcinoma. Nat Commun. 2021 Jul 2;12(1):4091.
5, Rozenberg et al., Molecules promoting circulating clusters of cancer cells suggest novel therapeutic targets for treatment of metastatic cancers. Front Immunol. 2023 Mar 15:14:1099921.
6, Sun et al., Platelet-mediated circulating tumor cell evasion from natural killer cell killing via immune checkpoint CD155-TIGIT. Hepatology, 2024 May 23.
7, Bach et al., Circulating Tumor DNA Analysis: Clinical Implications for Colorectal Cancer Patients. A Systematic Review. JNCI Cancer Spectr, 2019 Jun 19;3(3):pkz042.
8, Kim et al., Clinical Circulating Tumor DNA Testing for Precision Oncology. Cancer Res Treat, 2023 Apr;55(2):351-366.
9, Abbosh et al, Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution. Nature, 2018 Feb 8;554(7691):264.
10, Tie et al., Circulating Tumor DNA Analysis Guiding Adjuvant Therapy in Stage II Colon Cancer. N Engl J Med, 2022 Jun 16;386(24):2261-2272.
11, Bidard et al., Efficacy of Circulating Tumor Cell Count-Driven vs Clinician-Driven First-line Therapy Choice in Hormone Receptor-Positive, ERBB2-Negative Metastatic Breast Cancer: The STIC CTC Randomized Clinical Trial. JAMA Oncol, 2021 Jan 1;7(1):34-41.
12, Mahuron et al., Applications of Liquid Biopsy for Surgical Patients With Cancer: A Review. JAMA Surg. 2024 Jan 1;159(1):96-103.
13, Radovich et al., Association of Circulating Tumor DNA and Circulating Tumor Cells After Neoadjuvant Chemotherapy With Disease Recurrence in Patients With Triple-Negative Breast Cancer Preplanned Secondary Analysis of the BRE12-158 Randomized Clinical Trial. JAMA Oncol, 2020 Sep 1;6(9):1410-1415.
14, Zhang et al., Early evaluation of risk stratification and clinical outcomes for patients with advanced breast cancer through combined monitoring of baseline circulating tumor cells and DNA. Clin Cancer Res, 2024 Aug 15;30(16):3470-3480.