弱水三千中如何取出一瓢饮,谈谈CTC的富集和鉴定技术

摘要
CTC富集技术是CTC研究的基础,也是CTC研究的重点和难点。本文就CTC EpCAM阳性富集技术与阴性富集技术的进行重点比较,以基于细胞系spike-in样本和临床样本的头对头比较,显示顿慧医疗采取的EpCAM阴性富集技术展现出更佳的灵敏度和检出率,在CTC富集和检测中具有更显著的优势。
CTC作为液体活检的重要标志物,在临床中具有广泛的应用价值。然而,CTC的临床应用依然面临不小的挑战,具体包括细胞浓度低、细胞易降解、细胞难鉴别等。CTC的形态与白细胞类型,仅从形态角度加以区别显然有失偏颇,然后CTC又具有高度的异质性,常常发生表皮间充质化(EMT)等[1],这给CTC的富集和鉴定提出了不小的难题。
01. CTC富集和鉴定的方法学
CTC的富集主要基于其物理学和生物学特性进行,包括物理特性分离法、免疫亲和富集法以及基于细胞的物理和生化性质的联合分离法等[2]。在过去的几年里,微流控技术作为基于物理学特性富集的方法被广泛使用[3,4],而近几年基于标记富集的CTC富集技术则更为主流。目前FDA唯一获批的CTC检测平台是CellSearch,CellSearch是一类依据细胞表面蛋白EpCAM的抗体进行富集的方法[5]。
然而,有不少研究表明,CTC细胞具有EMT特性,EpCAM表达大大降低。例如,图1A针对4个前列腺癌细胞系的EpCAM和EMT marker Vimentin的流式结果显示,PC-3和PC-3M的Vimentin高表达,EpCAM的表达则大大下降[6];图1B针对胃癌患者的CTC进行EpCAM和EMT marker Vimentin的多色免疫荧光显示存在EpCAM-的间充质型CTC[7];图1C针对乳腺癌患者的CTC的多色免疫荧光同样支持存在EpCAM-的间充质型CTC[8];图1D针对卵巢癌患者腹水的CTC的单细胞测序结果进行分析显示,存在EpCAM+和EpCAM-两类CTC[9,10];图1E针对胰腺癌肝转移患者的原发灶、转移灶和外周血富集的CTC进行单细胞测序结果显示,CTC较原发灶和转移灶的肿瘤细胞相比,EpCAM的表达大大下降[11]。EpCAM在泛癌种的CTC中的表达水平的多样性显示仅局限于EpCAM的阳性富集可能会造成大量的假阴性,对于CTC富集的技术,可能需要持有更多元更谨慎的态度。

图1. CTC的EpCAM表达多样性
02. 顿慧医疗的EpCAM阴性富集策略
为解决EpCAM异质性对CTC富集的不良影响,顿慧医疗与复旦大学(附属中山医院)肝癌研究所樊嘉院士、杨欣荣教授合作开发的全自动的基于EpCAM阴性富集平台,包含阴性富集、免疫荧光标记和基于机器学习的CTC识别等步骤,富集的CTC可用于单细胞转录组测序、基因组测序、蛋白组学分析等多组学研究,大大扩展了CTC的临床和科研应用,相关研究发表于Molecular Oncology杂志[12]。
顿慧医疗所采用的EpCAM阴性富集和识别策略的优势在于:
1. 克服了EpCAM表达异质性引起的假阴性,大大提高了检出率。
2. 基于高维度信息抓取的图像识别获取细胞信息,更大限度地富集CTC,降低了假阴性,大大提高了检出率。
3. 基于人工智能的机器学习识别细胞,更大限度地准确识别CTC,降低了假阳性和假阴性,提高了CTC识别的准确性。
为进一步验证上述优势,该研究将4种EpCAM表达各异的细胞系以不同浓度加入到外周血样本中(图2A),与CellSearch平台进行头对头比较,其中EpCAM中、低表达的HepG2,SkBr3和T24细胞系显著高于CellSearch平台的回收率(图2B),凸显了顿慧医疗的阴性富集策略在EpCAM中、低表达样本中的检出优势。针对异质性更高的临床样本,顿慧医疗的阴性富集策略呈现更高的检出率(图2C)。
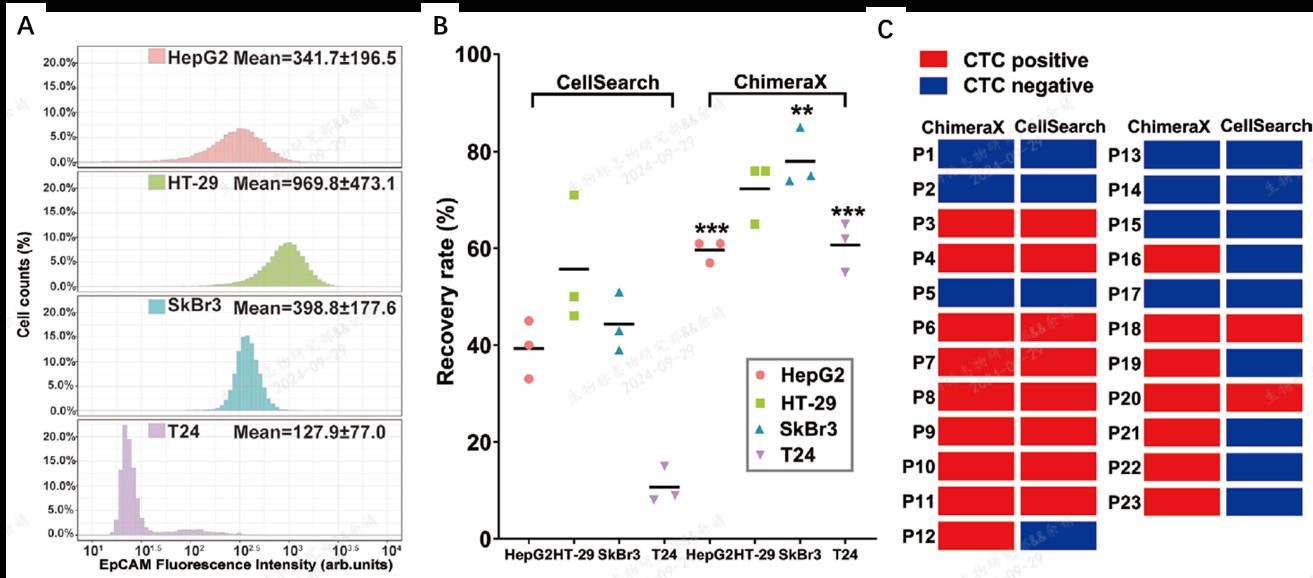
图2. EpCAM阴性富集策略和EpCAM阳性富集策略性能比较
小结
鉴于CTC的高度异质性,联合阴性富集和表面抗原marker的鉴定有利于更大程度地降低细胞损失和降低检测假阴性。顿慧医疗的阴性富集策略针对EpCAM中、低表达水平的CTC具有更显著的检测性能,因此阴性富集技术在CTC富集中具有更显著的优势。
参考文献:
[1], Naei et al., Advances in novel strategies for isolation, characterization, and analysis of CTCs and ctDNA. Ther Adv Med Oncol. 2023 Sep 7:15:17588359231192401.
[2], Banko et al., Technologies for circulating tumor cell separation from whole blood. J Hematol Oncol. 2019 May 14;12(1):48.
[3], Zhou et al., Isolation of circulating tumor cells in non-small-cell-lung-cancer patients using a multi-flow microfluidic channel. Microsyst Nanoeng. 2019 Feb 25:5:8.
[4], Warkiani et al., Ultra-fast, label-free isolation of circulating tumor cells from blood using spiral microfluidics. Nat Protoc. 2016 Jan;11(1):134-48.
[5], Riethdorf et al., Clinical applications of the Cell Search platform in cancer patients. Adv Drug Deliv Rev 125, 102–121.
[6],Lowes et al., Epithelial-to-mesenchymal transition leads to disease-stage differences in circulating tumor cell detection and metastasis in pre-clinical models of prostate cancer. Oncotarget. 2016 Nov 15;7(46):76125-76139.
[7],Hu et al., Epithelial-mesenchymal transition may be involved in the immune evasion of circulating gastric tumor cells via downregulation of ULBP1. Cancer Med. 2020 Apr;9(8):2686-2697.
[8], Guan et al., Epithelial-Mesenchymal-Transition-Like Circulating Tumor Cell-Associated White Blood Cell Clusters as a Prognostic Biomarker in HR-Positive/HER2-Negative Metastatic Breast Cancer. Front Oncol. 2021 Jun 2:11:602222.
[9], Izar et al., A single-cell landscape of high-grade serous ovarian cancer. Nat Med. 2020 Aug;26(8):1271-1279.
[10], Li et al., Genes (Basel). 2022 Dec 2;13(12):2276.
[11], Liu et al., Immune checkpoint HLA-E:CD94-NKG2A mediates evasion of circulating tumor cells from NK cell surveillance. Cancer Cell. 2023 Feb 13;41(2):272-287.e9.
[12], Wang et al., Circulating tumor cell detection and single-cell analysis using an integrated workflow based on ChimeraX®-i120 Platform: A prospective study. Mol Oncol. 2021 Sep;15(9):2345-2362.