温故知新 | CTC在外周血的免疫逃逸机制,揭秘CTC逃逸免疫杀伤的运动战

摘要
顿慧医疗与复旦大学附属中山医院检验科郭玮教授团队和肝外科孙云帆教授团队合作,于2024年5月在肝脏病学权威期刊《Hepatology》上发表了题为“Platelet-mediated circulating tumor cell evasion from natural killer cell killing via immune checkpoint CD155-TIGIT”的研究成果,阐明CTC可吸附血小板,通过CD155-TIGIT躲避外周的NK免疫监视。

CTC是转移的前体细胞,在转移过程中发挥至关重要的作用,但是CTC在血液中的含量极低,并且缺乏统一的表面标志物,富集CTC是研究重点难点问题。顿慧医疗利用ChimeraX® CTC平台基于负向筛选的富集,实现CTC高效富集,并通过免疫荧光染色进行CTC鉴定。在此基础上进行的定制分析解析CTC与血小板的粘附,精确分型血小板粘附型CTCs阳性和阴性的患者,提示血小板粘附CTC是泛癌种中的普遍现象,且与HCC不良预后相关。此外,顿慧医疗的CTC检测支持超高维度的形态学研究,联合人工智能分析进行CTC精准分层以探索更多的临床应用潜能,并可进一步联合基因组,转录组,蛋白组和代谢组等多组学分析为揭开CTC神秘面纱提供更多数据支持。该研究揭示了其介导肝癌CTC逃避固有免疫细胞杀伤的全新机制,为未来靶向CTC的新型治疗策略提供了新方向,有望突破目前针对免疫检查点的免疫治疗局限于肿瘤微环境和淋巴结中等组织样本,为液体活检提供新思路。
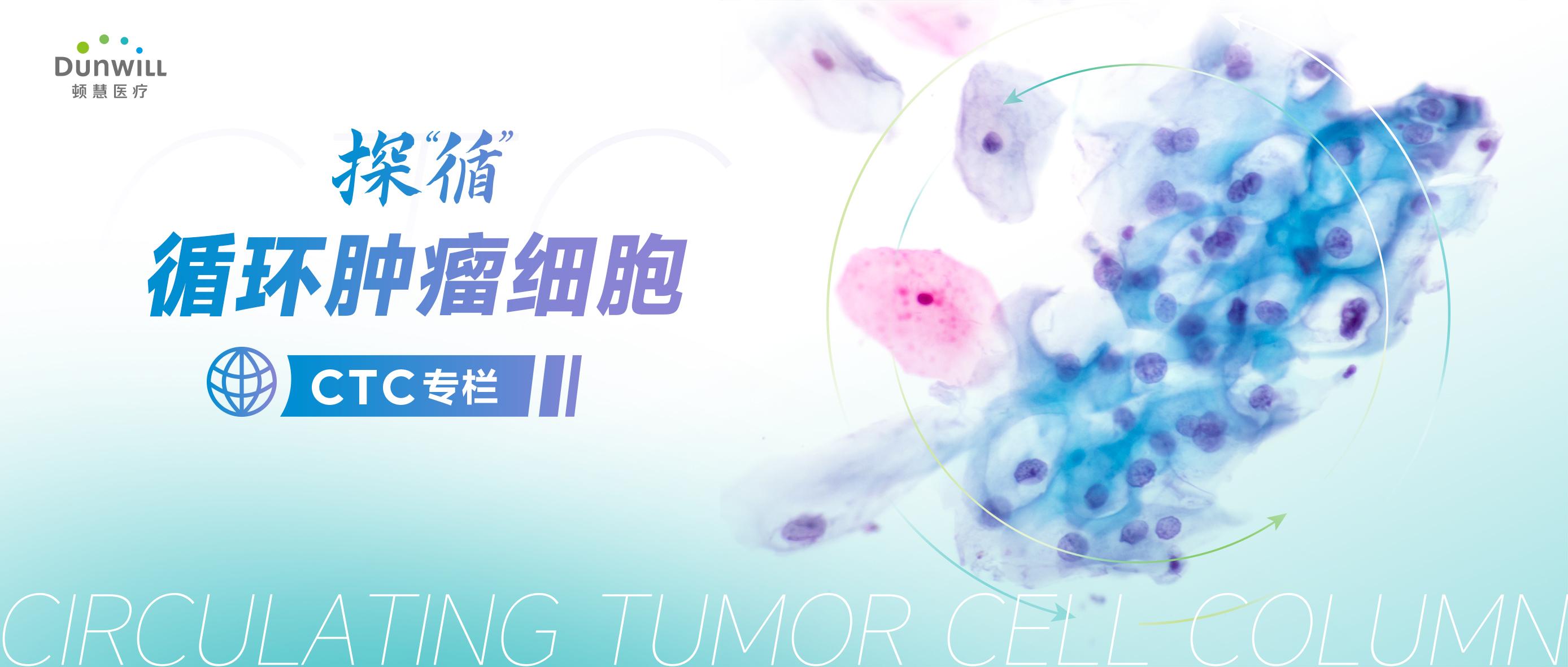
基于泛癌临床队列证实血小板粘附CTCs是一种普遍现象
作者以往的单细胞测序研究证明HCC患者的CTC细胞中高表达血小板相关基因表达,并且在NSCLC和PDAC中也有一致的结果。作者利用ChimeraX® CTC平台富集HCC、NSCLC和PDAC患者外周血的CTC,结合多色免疫荧光技术,发现大部分CTC阳性患者存在血小板粘附CTC的现象。更重要的是,在肝癌队列中,具有血小板粘附型CTC的患者的PFS和OS显著降低,以上结果证实了CTC可以直接与血小板粘附,与肝癌转移潜在相关,为预测肝癌患者预后提供了新型生物标志物。
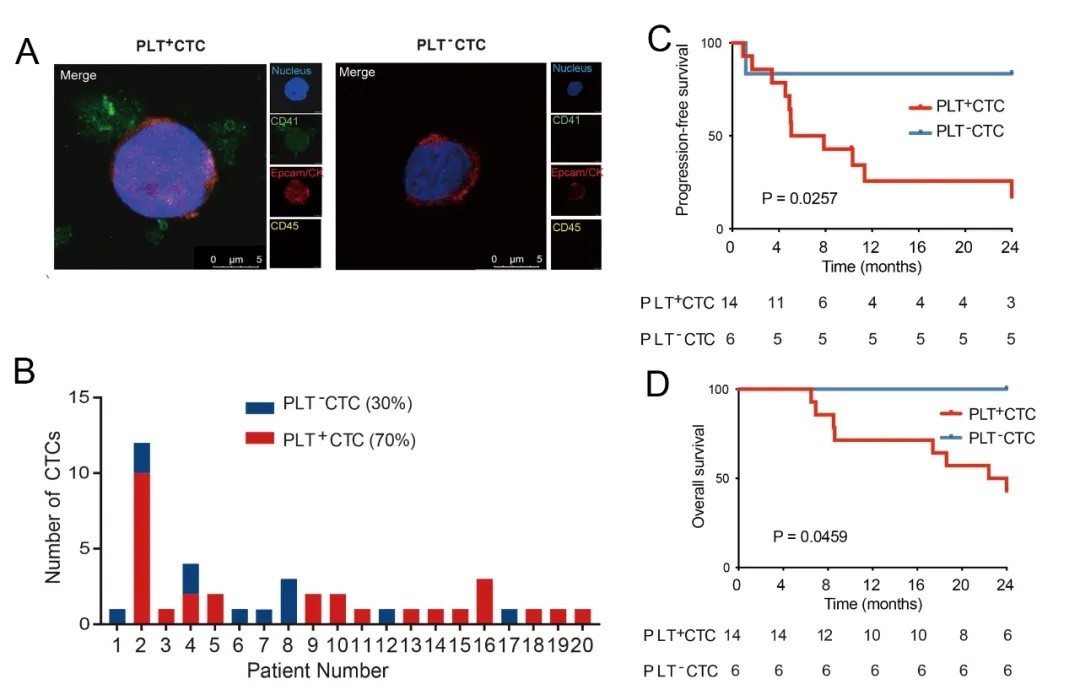
CTC与血小板粘附促进NK介导的免疫逃逸
为进一步明确血小板粘附CTC的临床应用价值,作者用luciferase标记的小鼠肝癌细胞系种植至免疫健全小鼠中,使用血小板抑制剂阻断血小板与CTC粘附后,肿瘤转移更少,而特异性抗体耗竭NK细胞后,这种转移的抑制效果被大大恢复。体外HCC细胞和NK细胞共培养也得到了一致的结果。以上结果证实了血小板粘附作用是CTC逃避NK细胞免疫监视的关键。靶向特异性抑制血小板与CTC粘附的新策略有望为抑制肝癌细胞免疫逃逸与转移提供新思路。
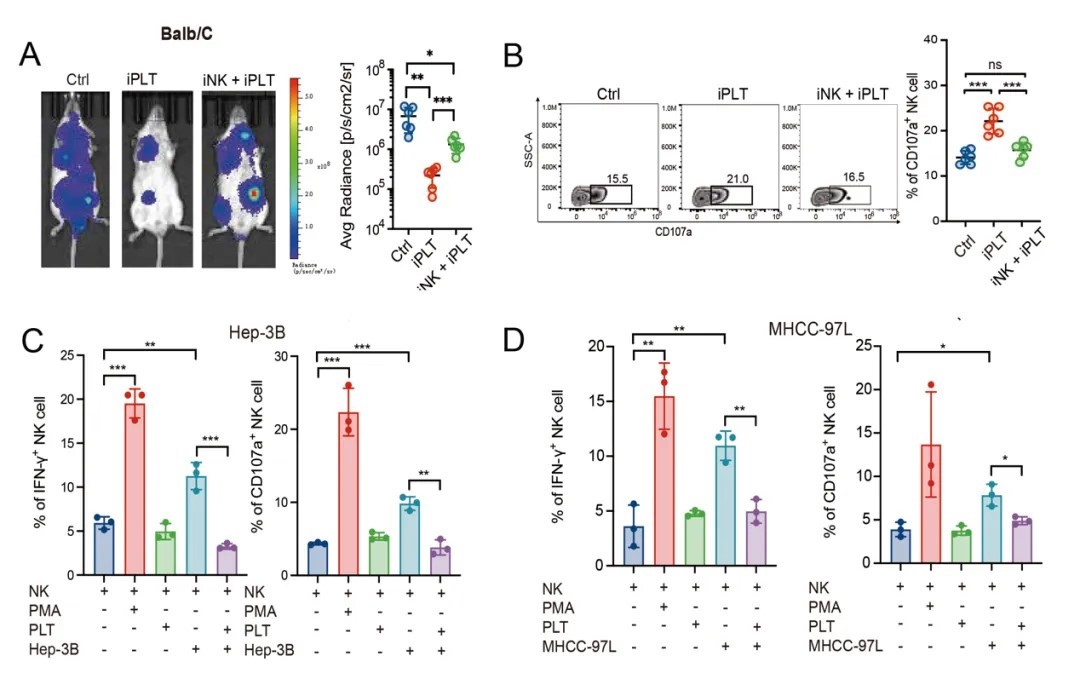
血小板粘附型CTC上调CD155,介导其躲避NK细胞杀伤
作者随后用细胞系和类器官进行验证。将血小板粘附HCC细胞系与NK细胞进行共培养后,NK细胞的CD155显著上调,而血小板清除后CD155无法上调。此外,在血小板粘附型CTC+的HCC患者中,CD155+的CTC细胞占比更高,说明血小板粘附促进CTC表达CD155。而后作用用体外共培养体系和模型小鼠验证血小板清除肿瘤转移能力的下降可被CD155过表达所恢复,而CD155敲低在即使没有血小板清除的情况下也能提高肺中杀伤性NK的浸润。
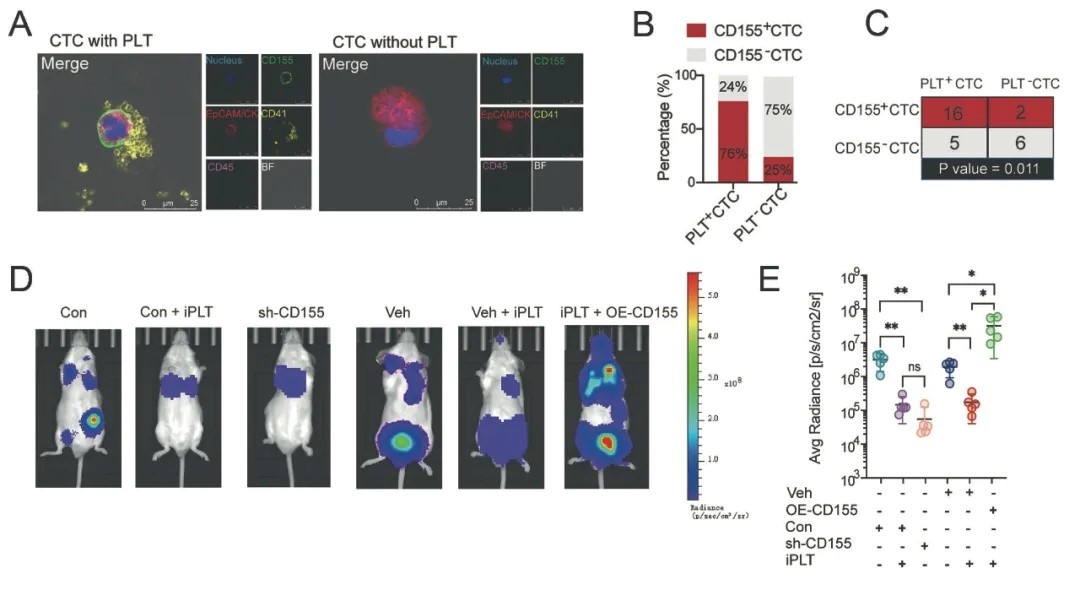
靶向抑制CD155-TIGIT结合可促进NK杀伤活性抑制肿瘤转移
CD155的受体是TIGTI和CD96,作者用两者的抗体进行中和处理血小板粘附预处理的肿瘤细胞与NK细胞体外共培养体系,仅anti-TIGIT增强了NK细胞杀伤性,体内实验获得一致的结论。以上结果说明CTC与NK通过CD155-TIGIT结合抑制NK的杀伤毒性,通过阻断两者结合可恢复NK细胞对CTC的免疫监视,为靶向循环内CTC清除提供了全新的免疫治疗策略。

结论
CTC从原发灶脱落至外周,最终到达转移器官定植,无时无刻不受免疫系统的监视,为躲避其监视作用,CTC形成了不同的免疫逃逸机制:一方面提升自己(降低T细胞执行的细胞死亡),一方面打压对手(促进T细胞终末耗竭),多管齐下,确保其完成转移使命。靶向CD155-TIGIT通路有望成为潜在的抑制肿瘤转移的新型治疗方案,强调新型免疫治疗策略不局限于在肿瘤原发灶中的应用,对血液循环中的肿瘤细胞也具有重要作用。