CTC应用于前列腺癌,百尺竿头,硕果累累,未来可期

摘要
关于CTC的研究和临床应用,前列腺癌一直发挥着排头兵的角色,在去势敏感性前列腺癌(HSPC)和去势抵抗性前列腺癌(CRPC)均有广泛报道,也有不少研究在诊断方面做出了积极的探索。本文将为您介绍CTC在前列腺癌中的应用,通过以往研究的深入学习助力您更好地开展新的研究。
CTC在mHSPC的临床应用
针对转移性HSPC(mHSPC),篇幅所限,仅拿SWOG S1216研究为例进行讨论。该研究纳入1313个mHSPC患者,其中795例进行了CTC检测,分析了基线CTC数目是mHSPC的PSA水平、疾病无进展生存和总生存的预后指标,相关研究相继于2021年发表于clinical cancer research和于2024年发表于JAMA。
在21年发表的CCR研究中,研究终点是7个月后PSA水平和2年PFS,证明基线CTC数目是良好预后的独立因素[1]。
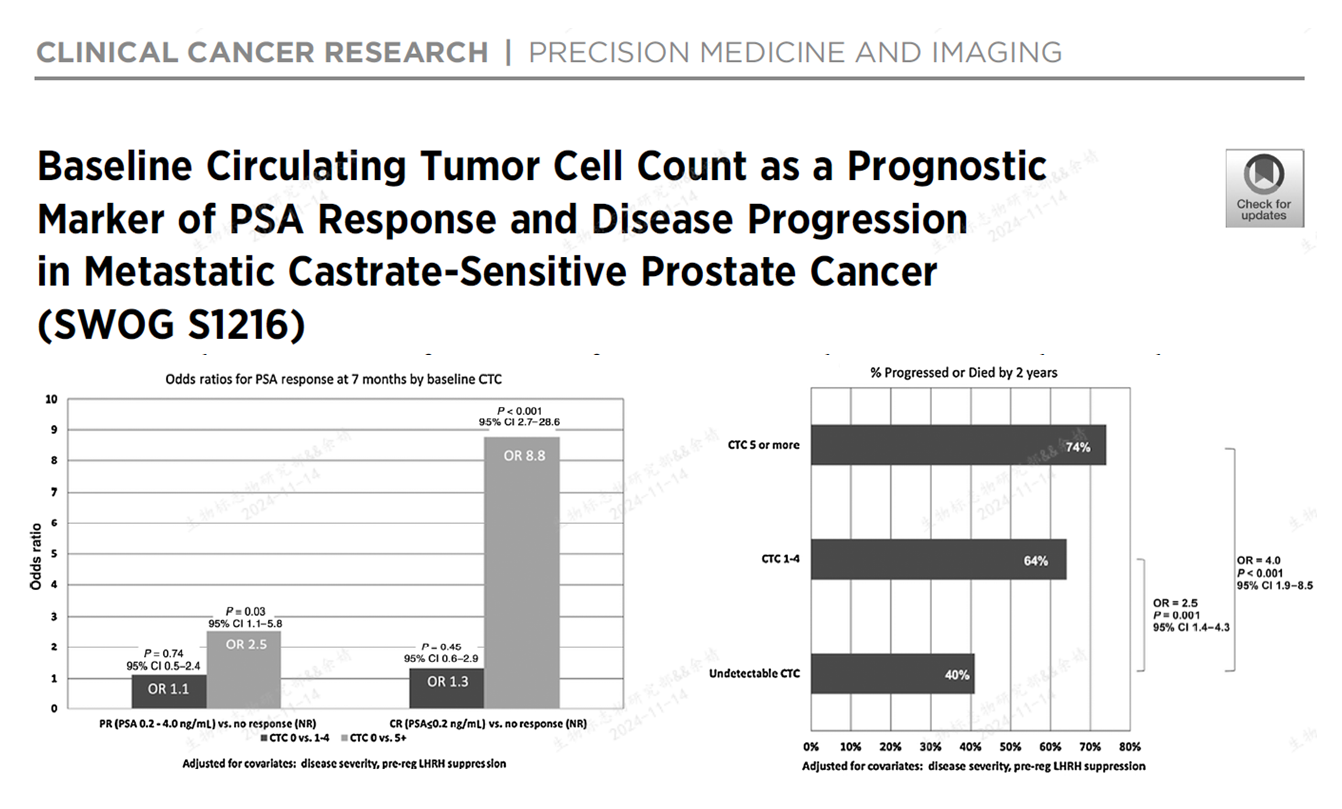
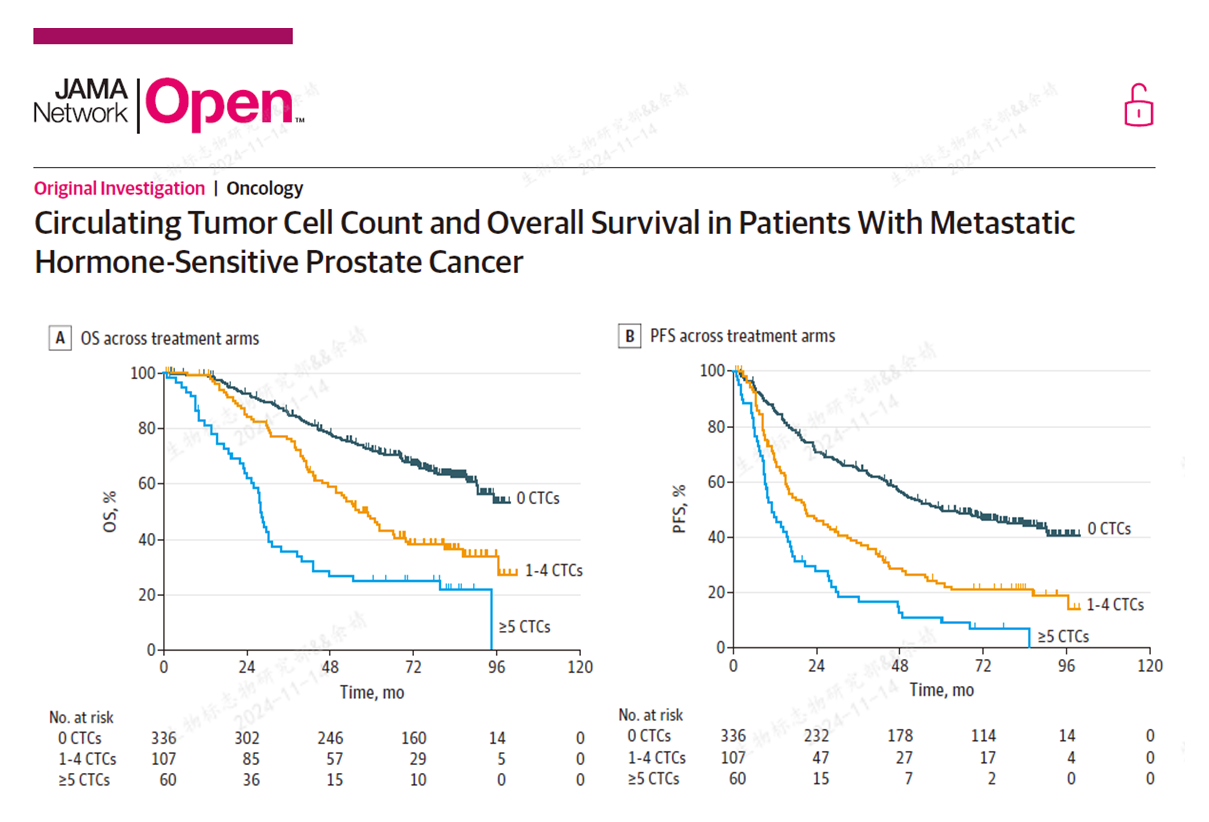
在24年发表的JAMA研究中,经过了平均78个月的随访,证明基线CTC数目是PFS和OS的独立预后因素[2]。
CTC在mCRPC的临床应用
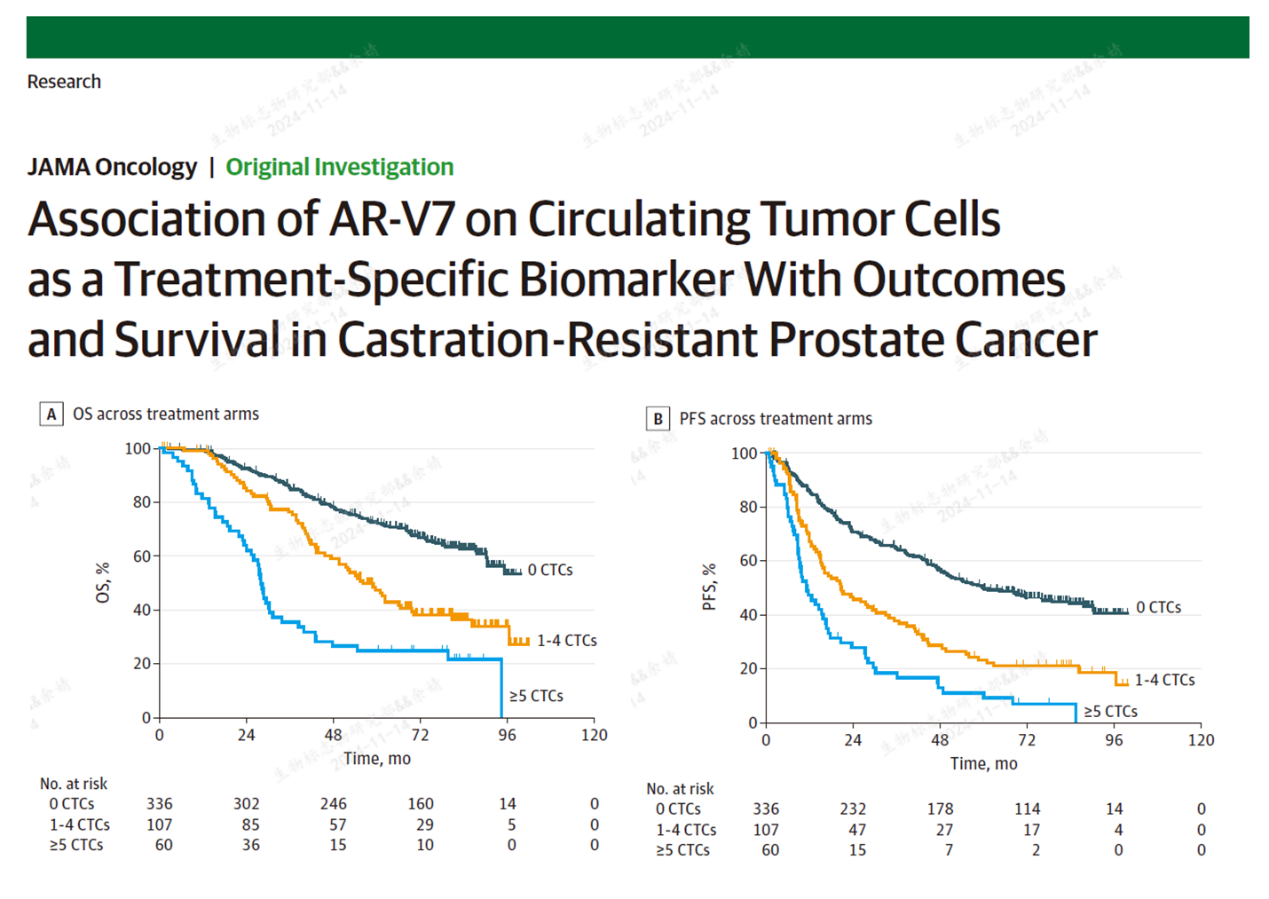
针对mCRPC患者,早在2016年就展开了深入的研究。发表于JAMA的这项研究表明,无论是雄激素受体抑制剂治疗还是化疗,治疗前CTC中AR-V7的表达量均与疗效显著相关[3]。2022年的NCCN指南推荐通过检测CTC上AR-V7的表达情况以指导其后续治疗的选择。
PROPHECY研究纳入118例mCRPC患者,其中97例进行了阿比特龙或恩杂鲁胺治疗前的CTC检测,57例在治疗进展后进行了CTC检测。针对CTC也进行了PSMA的染色,将CTC分为PSMA+ CTC和PSMA- CTC。PMSA-以及CTC-均是良好预后的独立因素[4]。

CTC应用于前列腺癌的诊断
相较于CTC在前列腺癌中的预后评估,CTC应用于诊断的报道则少了很多,这可能是因为即使在健康人中,也能检测到EpCAM+的细胞[5,6]。拷贝数变异(CNA)被认为是恶性细胞分子特征[7],2017年一项发表于CCR的研究利用5轮FISH的方法分析前列腺癌的CTC,以鉴定间质型和上皮型CTC的特征及遗传变异[8]。
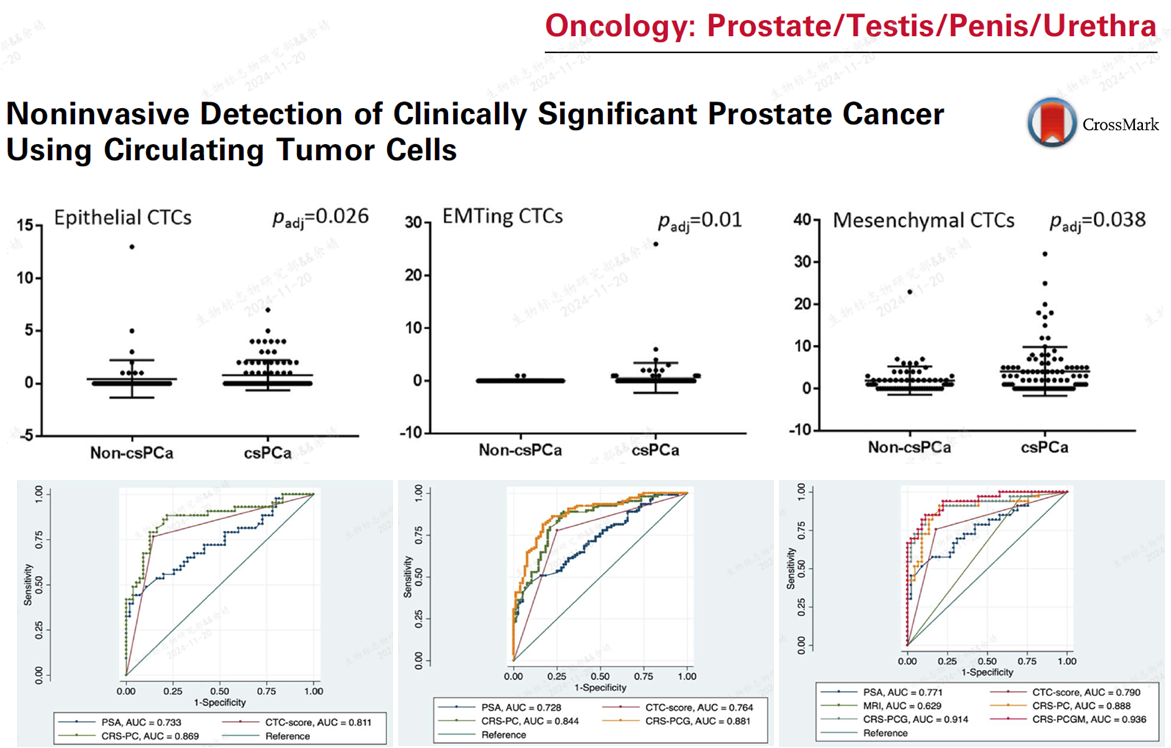
Xu等报道了利用Pan-CK和VIM鉴定出上皮型CTC,EMT型 CTC和间质型CTC,三种类型的CTC在非csPCa和PCa患者间存在显著差异;CTC csore较PSA具有更好的诊断csPCa的性能,而联合了CTC、PSA、MRI和CTC的12基因表达等多个指标,其AUC可达0.936,提示液体活检联合MRI在前列腺癌诊断中的重要价值[9]。
今年,在npj Precision Oncology发表了一项CNA精准鉴定CTC的研究。该研究针对CTC进行low path WGS,建立了一套scMet-seq方法。针对恶性腹水和良性腹水的样本进行scMet-seq检测,可以达到良好的诊断效果(AUC=0.941),大大提高了检测敏感性[10]。虽然该研究并未就前列腺癌展开特别的研究,我们有理由相信,CNA同样是前列腺癌CTC的分子特征,针对前列腺相关的体液样本的游离细胞的CNA检测,有望成为前列腺癌诊断的新方向。

CTC的检测技术、检出率和检出细胞数
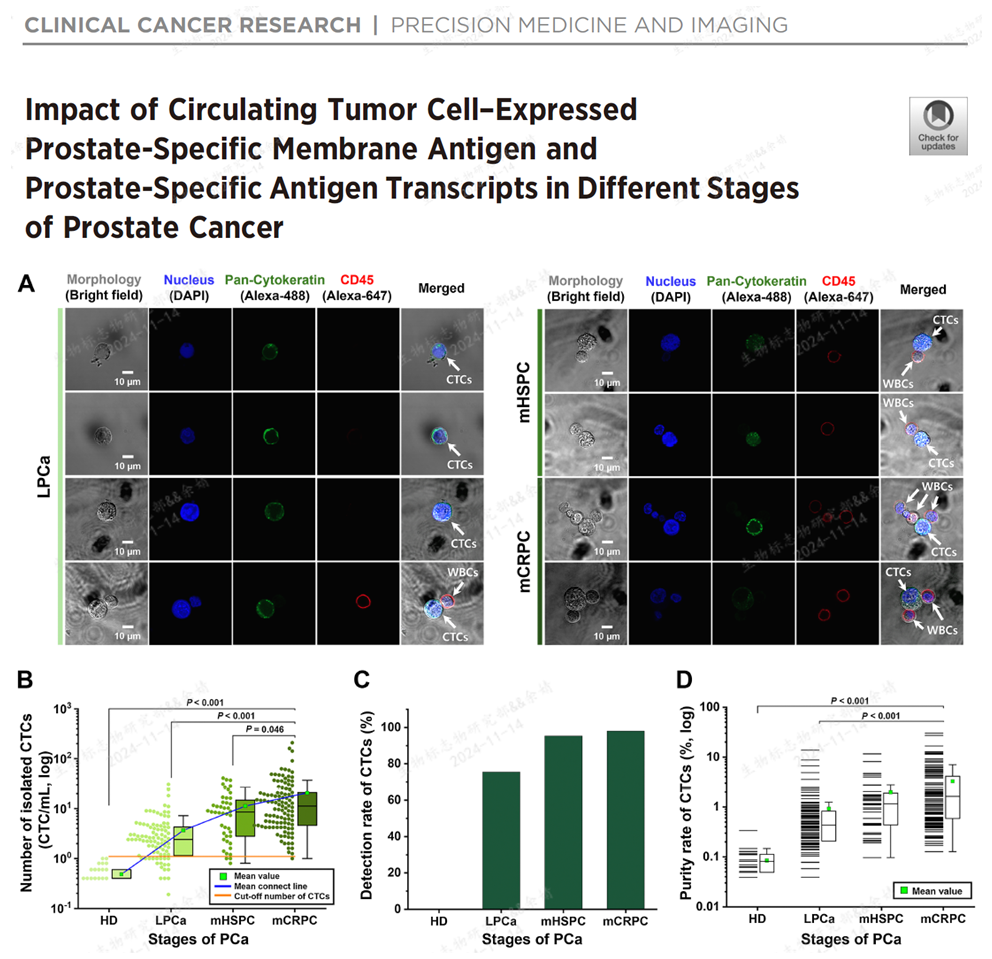
细心的读者可能已经发现了,在不同研究中,CTC的检出细胞数(CTC/mL),CTC的检出率(CTC阳性患者数/经CTC检测的总患者数)以及CTC的检测靶标(AR-V7, PSMA)等存在不小的差异。今天我们就各项研究的CTC检测技术层面参数再进行一个深入比较。 今年在CCR上发表了一篇针对不同PCa患者以及健康人的CTC检出情况的比较的研究。该研究采用的是微流控CTC富集技术,CTC判定标准是Pan-CK+ CD45- DAPI+。纳入了健康人、局限性前列腺癌(LPCa)、mHSPC和mCRPC患者进行研究。四个组别检出CTC的中位数目分别是0.5,3.7, 11.2和20.7 CTC/mL。以1.1 CTC/mL作为cutoff值,LPCa、mHSPC和mCRPC患者的检出率分别是75.5%,95.3%,98.0%。检出CTC数目占总细胞数的比例分别是0.08%,0.92%,2.64%和3.27%[5]。
在前述PROPHECY研究中,CTC检测用的是Epic Science平台,利用Pan-CK、CD45、DAPI和PSMA进行染色,鉴定出marker表达水平不同的CTC。其中治疗前的中位CTC数是9.57/mL,治疗后进展的是42.53/mL。治疗前患者的CTC检出率是80%,其中43例患者检出PSMA+ CTC。治疗后进展患者的CTC检出率是88%,其中34例患者检出PSMA+CTC[4]。

小结
综上所述,不同检测平台的CTC检出细胞数、检出率存在较大的差异,不过所有研究均一致的是:所有的平台CTC的判定标准都是Pan-CK+ CD45- DAPI+;都是越晚期的患者,CTC的检出细胞数和检出率都更高。针对特定平台的CTC检测性能,根据特定检测平台的检测性能建立个性化的cutoff值,是严谨的科学研究的必要步骤。
针对CTC在前列腺癌中的应用,无论在科研还是临床应用,无疑都是走在了各癌种的前列。不过这并不意味着CTC的研究已经到了尽头。CTC的检出率和针对CTC的深入研究是CTC研究的难点和热点,顿慧医疗与复旦大学肝癌研究所合作开发的全自动的不基于EpCAM表面抗原的阴性富集平台,显著提高了CTC的检出率,富集的CTC可用于单细胞转录组测序、基因组测序、蛋白组学分析等多组学研究,大大扩展了CTC的临床和科研应用[11]。在CTC在诊断中的应用,CTC的精准分型应用于更广泛的精准医疗,CTC的转移和免疫逃逸的机制等领域开展更深入的研究,无疑能帮我们揭开更多关于转移性前列腺癌的谜团。
参考文献:
1, Goldkorn et al., Baseline Circulating Tumor Cell Count as a Prognostic Marker of PSA Response and Disease Progression in Metastatic Castrate-Sensitive Prostate Cancer (SWOG S1216). Clin Cancer Res. 2021 Apr 1;27(7):1967-1973.
2, Goldkorn et al., Circulating Tumor Cell Count and Overall Survival in Patients With Metastatic Hormone-Sensitive Prostate Cancer. JAMA Netw Open. 2024 Oct 1;7(10):e2437871.
3, Scher et al., Association of AR-V7 on Circulating Tumor Cells as a Treatment-Specific Biomarker With Outcomes and Survival in Castration-Resistant Prostate Cancer. JAMA Oncol. 2016 Nov 1;2(11):1441-1449.
4, Gupta et al., PSMA-positive Circulating Tumor Cell Detection and Outcomes with Abiraterone or Enzalutamide Treatment in Men with Metastatic Castrate-resistant Prostate Cancer. Clin Cancer Res. 2023 May 15;29(10):1929-1937.
5, Cho et al., Impact of Circulating Tumor Cell–Expressed Prostate-Specific Membrane Antigen and Prostate-Specific Antigen Transcripts in Different Stages of Prostate Cancer. Clin Cancer Res. 2024 May 1;30(9):1788-1800.
6, Yang et al., Improving the diagnosis of prostate cancer by telomerase-positive circulating tumor cells: A prospective pilot study. EClinicalMedicine. 2022 Jan 10:43:101161.
7, Puram et al. Single-Cell Tranomic Analysis of Primary and Metastatic Tumor Ecosystems in Head and Neck Cancer. Cell. 2017 Dec 14;171(7):1611-1624.e24.
8, Xu et al., The Novel Association of Circulating Tumor Cells and Circulating Megakaryocytes with Prostate Cancer Prognosis. Clin Cancer Res. 2017 Sep 1;23(17):5112-5122.
9, Xu et al., Noninvasive Detection of Clinically Significant Prostate Cancer Using Circulating Tumor Cells. J Urol. 2020 Jan;203(1):73-82.
10, Shen et al., Single-cell low-pass whole genome sequencing accurately detects circulating tumor cells for liquid biopsy-based multi-cancer diagnosis. NPJ Precis Oncol. 2024 Feb 6;8(1):30.
11,Wang et al., Circulating tumor cell detection and single-cell analysis using an integrated workflow based on ChimeraX®-i120 Platform: A prospective study. Mol Oncol. 2021 Sep;15(9):2345-2362.