GenomeWeb专题报道发表于国际顶尖肿瘤学期刊《Cancer Cell》的突破性成果——国际首次绘制肝癌转移的时空多组学演化图谱

2023年12月15日,GenomeWeb报道了由复旦大学附属中山医院肝癌研究所樊嘉院士团队与上海科技大学张力烨团队及上海顿慧医疗合作发表于国际顶尖肿瘤学期刊《Cancer Cell》的题为Integrated multi-omics profiling to dissect the spatiotemporal evolution of metastatic hepatocellular carcinoma的研究成果。
研究内容
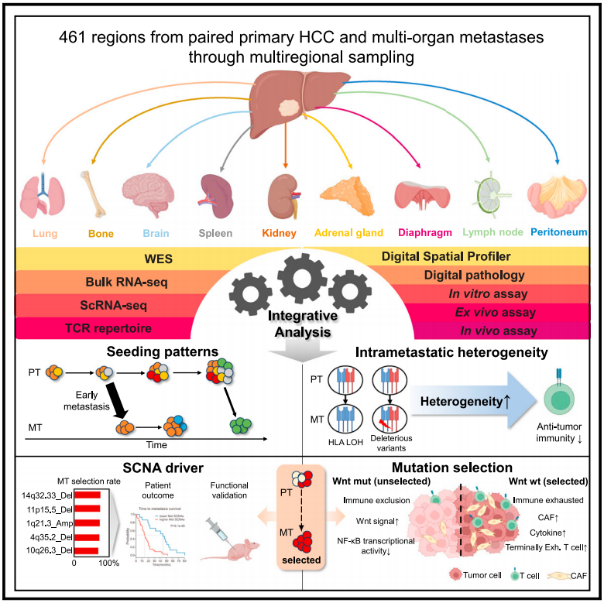
该研究从复旦大学附属中山医院和天津肿瘤医院肝癌样本库两万多例肝癌手术病人中筛选出182例肝细胞癌患者,并对原发灶、转移灶和肝内复发灶手术切除样本回顾性多区域取样,最终共收集461个石蜡包埋组织,进行基因组、转录组、单细胞转录组、空间转录组和数字病理等多组学联合测序分析。”
该研究综合时空多组学技术,绘制了肝癌转移过程的演化图谱,首次揭示了肝癌启动转移的分子时间,转移定植的克隆模式,转移肿瘤的瘤内异质性及其与微环境的相关性,驱动转移的关键事件,以及转移过程中克隆选择的机制。该研究成果为肝癌转移的精准诊疗提供了更深入的理论基础。”
GenomeWeb专题报道内容
多组学研究发现转移性肝癌特征
Metastatic Liver Cancer Characterized in Multiomic Study
来自中国的一个团队利用多组学方法,梳理出了转移性肝细胞癌 (HCC) 肿瘤内部和肿瘤间随着时间推移的分子特征,发现了显示早期转移扩散的多种肿瘤克隆。“传统上,肝癌转移被视为疾病的最终产物。”复旦大学肝癌研究所肝肿瘤外科研究员孙云帆解释道:“然而,我们的数据显示原发性肝癌和转移瘤之间存在高度的遗传差异,这反映出转移性前体在进化历史的早期就出现了。”正如在《Cancer Cell》上报道的那样,孙云帆和他的同事依靠外显子组测序和 RNA 测序,对 182 名转移性 HCC (mHCC) 肿瘤个体的 461 个福尔马林固定石蜡包埋的肿瘤区域进行了分析。基于基因组和转录组学图谱,结合转移瘤的数字空间图谱(DSP)、组织病理学、T细胞受体库和单细胞RNA-seq数据进行分析,该团队表征了mHCC肿瘤中发现的遗传异质性。孙云帆表示:“尽管监测和治疗策略取得了进展,提高了总体生存率,但转移仍然是患者死亡的主要原因,并且 HCC 基本上无法治愈。”他指出,“因此迫切需要更好地了解转移,以改善晚期 HCC 患者预后。”
在此过程中,研究人员标记了转移性肿瘤中可疑的驱动突变,包括体细胞拷贝数改变,同时还强调了 HCC 转移灶中往往缺乏的原发性肿瘤改变,例如影响 Wnt 信号通路的改变。“与之前对其他癌症类型的研究一致,我们没有发现复发的转移特异性突变。” 孙云帆解释道。“然而,在转移性HCC中,全基因组不稳定性明显增加,这表明体细胞拷贝数事件可能在实现转移潜力方面发挥关键作用。”
与此同时,研究人员利用来自具有多区域转移性肿瘤样本的mHCC 患者子集的数据,区分了以单个肿瘤亚克隆为标志的转移性播种事件或以多个亚克隆为标志的转移性播种事件,然后将多克隆播种与较差的患者预后联系起来。同时,原发性肿瘤和转移性肿瘤之间发现的基因组差异也表明了肝脏以外部位的早期转移播种,这暗示着可能有一个以前未被意识到的机会来消除正在接受手术治疗的个体中的微转移,以治愈局部肝癌。 孙云帆说,这些人可能有隐性癌细胞扩散到肝脏以外的地方。例如,他补充说,“可切除的 HCC 患者的新辅助治疗可能会减缓肿瘤进展并防止癌细胞进一步扩散”,而“术后辅助治疗可能有助于根除微小残留病灶。”
除了对肝外肝癌转移中存在的肿瘤变化有了新的认识之外,研究人员还继续探索这些肿瘤特征、免疫系统和肿瘤微环境之间的关系。例如,尽管mHCC肿瘤通常以高瘤内异质性(ITH)为标志,有望为免疫系统产生新抗原靶点,但他们的研究结果显示,T细胞对高ITC、高新抗原肿瘤的免疫反应减少,他们将这种影响归因于抗原提呈能力的改变。孙云帆解释说:“我们发现的证据表明,来自新抗原ITH高转移的肿瘤细胞获得了遗传畸变,这些畸变在转移播种后破坏了抗原呈递,这可能导致免疫原性降低。”由于过去的研究已经描述了以低新抗原 ITH为标志的晚期非小细胞肺癌病例中持久的免疫检查点阻断免疫治疗反应,孙云帆指出,新发现也可能为预测mHCC对检查点免疫治疗的反应提供新抗原线索。根据这些和其他发现,孙云帆进一步提出,“免疫检查点阻断 (ICB) 等围手术期全身治疗可以为可切除的HCC提供生存获益,鉴于几项评估围手术期免疫治疗作用的II期研究,这具有巨大的临床意义。” 另一方面,Wnt野生型mHCC肿瘤往往与包含癌症相关成纤维细胞的“反应性”或炎症性肿瘤微环境相对应,作者解释道,并指出“逆转纤维炎症生态系统可能是预防转移扩散的有效治疗策略。”
孙云帆副研究员表示:“目前临床上肝癌转移病灶的治疗效果都不太理想,没有扎实的基础和转化研究,很难推进临床新技术的发展,导致临床上缺少有效预测肝癌转移的工具,以及预防或治疗肝癌转移的新药物。基于这个出发点,我们在樊院士的领导下,于2018年开始了本项研究。通过这个大队列整合多组学的研究,我们希望回答一系列有关肝癌转移演进过程的核心科学问题,例如肝癌启动转移的分子时间,转移定植的克隆模式,转移肿瘤的瘤内异质性及其与微环境的相关性,驱动转移的关键进化事件,以及转移过程中克隆选择的机制。未来我们将针对本项研究中发现的与驱动肝癌转移密切相关的分子标志物,通过临床转化研究,研发预警和监测肝癌转移的临床分子检测试剂盒;同时在我们现有多组学基础上,进一步丰富组学的维度,例如增加表观和蛋白质组,以及空间转录组,希望发现更多能在临床上转化应用的作为转移预测和治疗的分子靶标。”
复旦大学附属中山医院樊嘉院士、上海科技大学张力烨研究员、复旦大学附属中山医院孙云帆副研究员及上海顿慧医疗彭海翔博士为本文共同通讯作者,孙云帆副研究员、吴频博士、张泽凡博士、王泽健博士、周恺乾博士、宋敏芳博士、纪元教授、臧凤琳教授为该研究共同第一作者。该课题得到了国家自然科学基金、上海市创新集群等项目资助,顿慧医疗和上海科技大学超算中心为多组学数据产出和生物信息分析提供了大力支持。”





